



衰老是生命进程中不可逆转的自然现象,其核心特征在于机体组织稳态失衡与再生修复能力的渐进性丧失,而干细胞作为维系机体组织更新与损伤修复的“种子细胞”,其衰老进程被认为是驱动机体整体衰老的关键枢纽。大量研究证实,干细胞功能衰退会直接引发血液造血能力下降、肌肉再生迟缓、神经信号传递障碍、肠道屏障功能弱化等一系列组织器官退行性改变,最终表现为皮肤皱纹、免疫力衰减、记忆力减退等衰老表象,甚至诱发骨质疏松、阿尔茨海默病、心血管疾病等衰老相关疾病。因此,解析干细胞衰老的核心机制、探索精准干预策略,已成为全球生命科学领域的前沿热点方向,相关研究成果为破解衰老密码、实现健康老龄化提供了重要理论支撑。
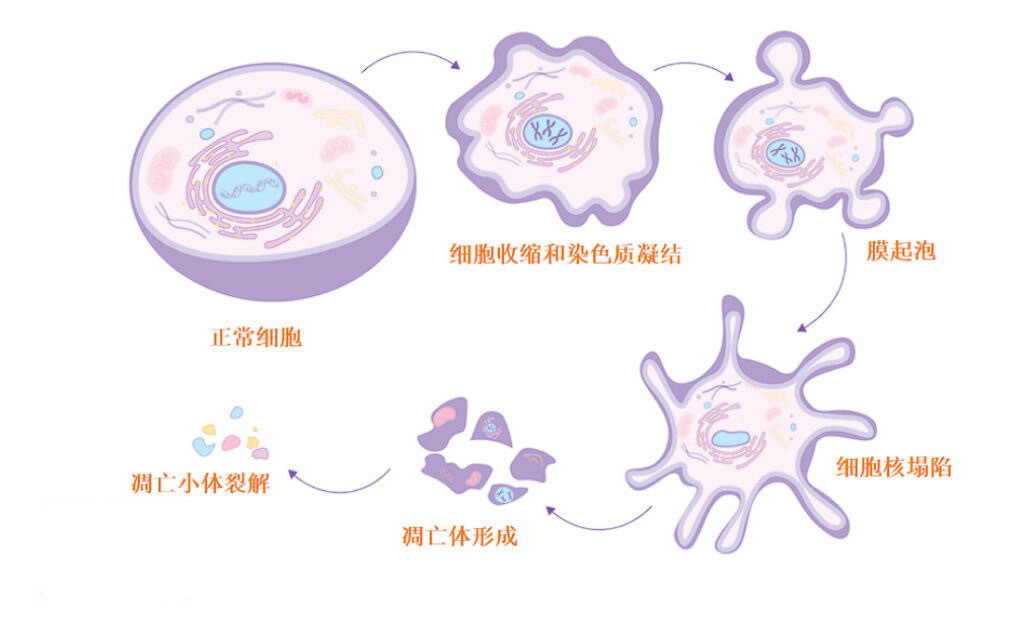
1.静息状态失衡:静息状态是干细胞维持自我更新能力的关键状态,正常干细胞通过精准调控静息深度实现“按需激活”。而衰老干细胞的静息状态呈现双向失衡特征:一方面可能陷入深度静息状态,导致机体遭受损伤时无法及时激活启动修复程序;另一方面可能静息状态过浅,引发异常增殖导致干细胞池提前耗竭,破坏组织稳态。例如,美法科学家团队(西奈山伊坎医学院和巴黎西岱大学)在《Cell Stem Cell》发表的研究证实,衰老造血干细胞因溶酶体功能紊乱导致静息状态失衡,表现为异常活跃的代谢特征,最终丧失正常造血功能。
2.自我更新倾向偏移:自我更新能力是干细胞区别于普通细胞的核心属性,衰老会导致该能力出现方向性偏移。具体表现为两种极端情况:一是过度增殖但功能退化,分裂产生的子代细胞不具备正常干细胞活性;二是增殖能力显著不足,无法及时补充干细胞池数量,导致组织再生修复能力持续下降。研究发现,这种偏移会显著增加血液系统恶性肿瘤、骨质疏松等疾病的发生风险,尤其在老年人群的间充质干细胞中表现最为明显。
3.细胞命运异常:干细胞的正常分化轨迹被打破,出现分化方向偏移或产生功能异常的子代细胞,这是干细胞衰老的重要功能性标志。典型案例包括造血干细胞衰老后呈现明显的髓系分化偏倚,导致粒细胞、单核细胞比例异常升高,而淋巴细胞生成减少,直接引发免疫力下降;肌肉干细胞衰老后则倾向于分化为成纤维细胞,导致肌肉组织纤维化,加剧肌肉萎缩。中国科学院广州生物医药与健康研究院刘兴国课题组的研究证实,衰老干细胞的命运异常与表观遗传调控网络紊乱密切相关,其提出的“表观组—代谢组—表观组”跨界级联反应机制为该现象提供了科学解释。
4.应激耐受性改变:年轻干细胞具备强大的应激适应能力,可通过自噬、抗氧化等机制应对缺氧、氧化损伤等内外环境压力。而衰老干细胞的应激耐受性显著下降,面对压力时要么过度凋亡导致干细胞数量减少,要么异常存活并积累DNA损伤,进而向周围组织释放促炎因子,破坏局部微环境稳态。国家科技图书文献中心收录的研究表明,天然免疫蛋白RIG-I的异常激活会加剧干细胞的应激敏感性,影响造血干细胞细胞周期及造血重建能力,加速衰老进程。
5.群体异质性失调:干细胞群体的多样性是维持组织稳态的重要保障,衰老会导致这一平衡被打破。初始阶段的基因突变积累会加剧干细胞群体的异质性,后续通过克隆选择优势,部分异常干细胞会大量增殖,导致群体多样性降低。这种失调会显著提升衰老相关疾病的发生概率,例如造血干细胞群体异质性失调是老年白血病的重要诱因之一,相关机制已在多项临床前研究中得到验证。
上述五大功能性标志并非孤立存在,而是通过复杂的分子调控网络相互关联,共同驱动机体衰老进程。这些标志在不同类型干细胞中呈现出特异性表达特征:造血干细胞主要表现为静息失衡与群体异质性失调,神经干细胞以细胞命运异常和应激耐受性下降为核心特征,皮肤干细胞则突出表现为自我更新倾向偏移。大量临床前研究证实,靶向调控这些功能性标志可有效延缓对应组织的衰老进程,例如美法科学家团队的研究显示,通过纠正造血干细胞的溶酶体功能紊乱,可使其造血能力提升8倍并恢复年轻化特征,这为后续干预策略的开发提供了明确靶点。

针对干细胞衰老的五大核心功能性标志,全球科研界已构建起涵盖环境调控、代谢干预、物理刺激、药物靶向及基因编辑的多层次干预框架。这些策略通过精准靶向衰老调控的关键分子通路,实现对干细胞衰老进程的有效逆转或延缓,相关研究已在小鼠、食蟹猴等多种动物模型中取得突破性进展,并逐步向临床转化探索推进。以下将结合最新研究成果,对各干预策略的作用机制、实验效果及文献依据进行详细阐述:
•系统性微环境调控:干细胞的功能状态高度依赖其所处的微环境(干细胞巢),衰老微环境中的促炎因子积累、营养供应不足等是加速干细胞衰老的重要外在因素。该策略通过改善干细胞生存的微环境实现抗衰老效果,典型手段包括异龄共生、年轻血浆移植等。研究证实,年轻血浆中含有的GDF11等年轻化因子可显著改善老年干细胞的增殖与分化能力,逆转部分衰老表型。中国科学院动物研究所团队的研究进一步发现,通过移植工程化抗衰型间充质祖细胞(SRC),可通过释放外泌体调控微环境稳态,在灵长类模型中实现多器官衰老进程的延缓。
•代谢与营养干预:代谢重编程是调控干细胞衰老的关键切入点,该策略通过调整营养摄入模式或补充特定代谢前体,优化干细胞的能量代谢状态。热量限制、间歇性断食可通过激活AMPK信号通路,抑制干细胞的异常代谢,维持其静息状态与自我更新能力。《Journal of Biological Chemistry》发表的研究证实,AMPK信号的激活可诱导肌肉卫星细胞发生Warburg样糖酵解,促进其激活与增殖,提升肌肉再生能力。此外,补充烟酰胺核苷、β-羟基丁酸等代谢前体,可通过调节NAD+水平、改善表观遗传状态,有效延缓间充质干细胞、神经干细胞的衰老进程。
•物理干预手段:通过物理刺激调控干细胞功能是一种安全可控的干预方式,主要包括规律运动与机械刺激。规律运动可通过降低机体慢性炎症水平、上调IGF-1等再生相关因子的表达,改善干细胞微环境,恢复干细胞的正常分化命运。机械刺激则通过调节细胞外基质的刚度,影响干细胞的力学感知信号,例如在骨组织工程中,适宜的机械载荷可显著提升间充质干细胞的成骨分化能力,延缓其衰老相关的成脂分化偏移。相关研究已在肌肉再生、骨修复等领域取得临床前应用进展。
•靶向药物治疗:通过小分子药物靶向衰老相关信号通路,是实现干细胞衰老干预的高效策略。雷帕霉素作为经典的mTOR信号抑制剂,可显著抑制间充质干细胞的衰老进程,维持其克隆形成能力与成骨分化潜能,相关机制与下调活性氧水平、减少DNA损伤积累有关。二甲双胍则通过激活AMPK通路,改善干细胞的代谢紊乱,在造血干细胞、神经干细胞等多种类型中均展现出抗衰老效果。此外,RIG-I小分子抑制剂RIG012等新型药物的开发,为靶向天然免疫通路调控干细胞衰老提供了新方向。
•基因与表观遗传调节:通过基因编辑或表观遗传修饰逆转干细胞的衰老状态,是近年来的研究热点。OSKM因子介导的部分重编程可有效逆转干细胞的表观遗传漂移,恢复其年轻化特征,且避免了完全重编程带来的致瘤风险。中国科学院动物研究所团队通过对长寿基因FOXO3进行双位点工程化改造,构建的抗衰型间充质祖细胞(SRC 2.0),在灵长类模型中实现了神经元、卵母细胞等细胞类型的生物学年龄逆转。此外,HDAC抑制剂、DNA甲基转移酶抑制剂等表观遗传调控药物,也可通过重塑干细胞的表观遗传图谱,延缓衰老进程。
当前,干细胞衰老领域的基础研究已在动物模型中取得诸多突破性进展,例如中国科学院动物研究所团队的研究显示,通过SRC细胞移植可使老年食蟹猴的未成熟神经元生物学年龄逆转6-7岁,卵母细胞生物学年龄逆转5岁,且未出现致瘤等不良事件;美法科学家团队的研究证实,靶向造血干细胞溶酶体功能的干预策略,可使其造血能力提升8倍并恢复年轻化表型。但从基础研究向人类临床转化,仍需突破三大核心瓶颈:一是人源化模型开发不足,现有动物模型难以完全模拟人类干细胞衰老的复杂机制;二是多组学机制解析不透彻,干细胞衰老的分子调控网络尚未完全阐明,制约了精准干预靶点的开发;三是干预策略的精准化与安全性评估体系不完善,临床应用的长期风险尚不明确。
未来,随着诱导多能干细胞技术的迭代升级、AI驱动的衰老时钟预测模型的优化,以及合成生物学与再生医学的跨学科融合,有望实现从基础研究到临床应用的高效转化。例如,通过AI技术可精准预测干细胞的衰老状态与干预效果,为个性化干预方案的制定提供支撑;合成生物学技术则可构建更安全、高效的工程化抗衰细胞,提升临床干预的有效性与安全性。这些创新手段的融合应用,将为延长人类健康寿命、防治阿尔茨海默病、骨质疏松症等衰老相关疾病提供全新的解决方案。
干细胞衰老研究的深入推进,不仅从分子层面深化了我们对生命老化本质的认知,揭示了“干细胞衰老-组织退化-机体衰老”的核心调控链条,更构建了精准化、多层次的衰老干预技术体系。从基因编辑工程化细胞到小分子靶向药物,从微环境调控到代谢干预,一系列创新策略的开发与应用,为打破“衰老不可逆转”的传统认知提供了科学依据。尤其值得关注的是,中国科学院等团队在灵长类动物模型中取得的突破性进展,为人类衰老干预的临床转化奠定了坚实基础。未来,随着研究的持续深入与技术的不断突破,干细胞衰老干预技术有望成为实现健康老龄化的核心支撑,为提升人类生命质量、应对全球人口老龄化挑战提供重要的科学保障与技术支撑。
参考文献
[1] 加州大学洛杉矶分校, 斯坦福大学. 干细胞衰老的五大核心功能性标志[J]. Cell Stem Cell, 2025.
[2] Gafuri S, et al. Reversing aging of hematopoietic stem cells by correcting lysosomal dysfunction[J]. Cell Stem Cell, 2025.
[3] Liu X G, et al. Cross-border "butterfly effect" in stem cell fate regulation[J]. Nature Metabolism, 2025.
[4] 国家自然科学基金委员会. Rig-I对造血干细胞细胞周期及造血重建能力的调节作用及机制研究[R]. 2011.